کاتالیز آنزیم
کاتالیز آنزیم عبارت است از افزایش سرعت یک فرایند توسط یک مولکول بیولوژیکی مانند یک " آنزیم ". بیشتر آنزیمها پروتئین هستند و بیشتر این فرایندها واکنشهای شیمیایی هستند. در داخل آنزیم، بهطور کلی تجزیه در یک مکان محلی به نام جایگاه فعال رخ میدهد.
بیشتر آنزیمها عمدتاً از پروتئینها ساخته میشوند، یا یک زنجیره پروتئینی منفرد یا بسیاری از این زنجیرهها در یک مجموعه دارای چند زیر واحد هستند. آنزیمها غالباً از اجزای غیر پروتئینی مانند یونهای فلزی یا مولکولهای آلی خاص معروف به کوفاکتور استفاده میکنند (به عنوان مثال آدنوزین تری فسفات). بسیاری از کوفاکتورها ویتامین هستند و نقش آنها به عنوان ویتامینها ارتباط مستقیمی با استفاده از آنها در تجزیه فرایند بیولوژیکی درون متابولیسم دارد. فروکافت واکنشهای بیوشیمیایی در سلول حیاتی است زیرا بسیاری از واکنشهای ضروری از نظر متابولیکی در شرایط غیر کالیزاسیون سرعت بسیار کمی دارند. یکی از محرکهای تکامل پروتئین بهینهسازی چنین فعالیتهای کاتالیزوری است، اگرچه تنها، مهمترین آنزیمها در نزدیکی محدودیتهای کارایی کاتالیزوری کار میکنند و بسیاری از آنزیمها از حد مطلوب دور هستند. از فاکتورهای مهم در تجزیه آنزیم میتوان به تجزیه عمومی اسید و باز، فرمان مداری، محدودیت آنتروپیک، اثرات جهتگیری (به عنوان مثال آنالیز قفل و کلید) و همچنین اثرات حرکتی شامل پویایی پروتئین اشاره کرد[۱]
مکانیسمهای کاتالیز آنزیمها متفاوت است، اما از نظر اصولی همگی به انواع دیگر تجزیه شیمیایی شباهت دارند، زیرا عامل مهم کاهش سد انرژی (انرژی) جدا کننده واکنش دهندهها (یا بسترها از محصولات) است. کاهش انرژی فعال سازی (E a) کسری از مولکولهای واکنش دهنده را افزایش میدهد که میتوانند بر این سد غلبه کرده و محصول را تشکیل دهند. یک اصل مهم این است که از آنجا که آنها فقط موانع انرژی بین محصولات و واکنش دهندهها را کاهش میدهند، آنزیمها همیشه واکنشها را در هر دو جهت کاتالیز میکنند و نمیتوانند یک واکنش را به جلو هدایت کنند یا بر موقعیت تعادل تأثیر بگذارند. همانند سایر کاتالیزورها، آنزیم توسط واکنش مصرف نمیشود یا تغییر نمیکند (همانطور که یک بستر است) بلکه به گونه ای بازیافت میشود که یک آنزیم منفرد دورهای زیادی از تجزیه را انجام میدهد.
آنزیمها اغلب بسیار خاص هستند و فقط بر روی لایههای خاصی عمل میکنند. برخی از آنزیمها کاملاً معنی خاصی دارند که فقط بر روی یک بستر ویژه عمل میکنند، در حالی که برخی دیگر خاصیت گروهی را نشان میدهند و میتوانند بر روی گروههای شیمیایی مشابه اما نه یکسان مانند پیوند پپتید در مولکولهای مختلف عمل کنند. بسیاری از آنزیمها خاصیت استریوشیمیایی دارند و بر اساس یک استریوایزومر عمل میکنند.
تناسب القایی
[ویرایش]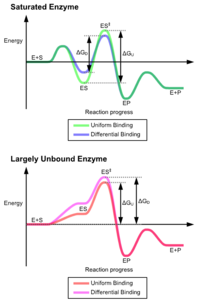
مدل کلاسیک برای برهم کنش آنزیم - بستر، مدل برازش ناشی از آن است.[۲] این مدل پیشنهاد میکند که فعل و انفعالات اولیه بین آنزیم و بستر نسبتاً ضعیف است، اما این فعل و انفعالات ضعیف به سرعت باعث ایجاد تغییرات ساختاری در آنزیم میشود که اتصال را تقویت میکند.
نمونههایی از مکانیسمهای کاتالیزوری
[ویرایش]در حقیقت، بیشتر مکانیسمهای آنزیمی شامل ترکیبی از چندین نوع مختلف تجزیه است.
ایزومراز فسفات تریوز
[ویرایش]تریوز فسفات ایزومراز (EC 5.3.1.1) تبدیل متقابل برگشتپذیر دو همپار دیهیدروکسیاستون فسفات و گلیسرآلدئید-۳-فسفات را کاتالیز میکند.
تریپسین
[ویرایش]تریپسین (عدد گروه آنزیم 3.4.21.4) یک سرین پروتئاز است که پس از باقیماندههای لیزین یا آرژنین با استفاده از یک سهگانه کاتالیزوری برای انجام تجزیه کووالانسی و یک حفره اکسیانیون، لایههای پروتئینی را میشکافد تا تجمع بار را در حالتهای گذار تثبیت کند.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ Kamerlin, S. C.; Warshel, A (2010). "At the dawn of the 21st century: Is dynamics the missing link for understanding enzyme catalysis?". Proteins: Structure, Function, and Bioinformatics. 78 (6): 1339–75. doi:10.1002/prot.22654. PMC 2841229. PMID 20099310.
- ↑ Koshland DE (February 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". مقالات آکادمی ملی علوم ایالات متحده آمریکا. 44 (2): 98–104. Bibcode:1958PNAS...44...98K. doi:10.1073/pnas.44.2.98. PMC 335371. PMID 16590179.

برای مطالعهٔ بیشتر
[ویرایش]- Alan Fersht, Structure and Mechanism in Protein Science: A Guide to Enzyme Catalysis and Protein Folding. W. H. Freeman, 1998. شابک ۰-۷۱۶۷-۳۲۶۸-۸شماره استاندارد بینالمللی کتاب ۰-۷۱۶۷-۳۲۶۸-۸
- Dedicated issue of Philosophical Transactions B on Quantum catalysis in enzymes freely available.[پیوند مرده]
پیوند به بیرون
[ویرایش] پروندههای رسانهای مربوط به Enzyme catalysis در ویکیانبار
پروندههای رسانهای مربوط به Enzyme catalysis در ویکیانبار
